遺伝毒性試験(Ames試験・小核試験・染色体異常試験)
細菌を用いる復帰突然変異試験(Ames試験)
1菌株のスクリーニングから各種GLP試験まで幅広く受託しています。経験豊富なスタッフがスピーディに対応いたします。お急ぎの方も是非お問い合わせください。
【関連ページ】細菌を用いる復帰突然変異試験 (微生物を用いる変異原性試験、Ames試験)の用途別プラン
【関連記事】変異原性・遺伝毒性とは?
【関連記事】変異原性試験とは?
Ames試験とは
細胞内の遺伝子DNAレベルで突然変異が起こると、DNAを構成する塩基にさまざまな変化が生じます。突然変異が起こったDNAが複製されることにより、細胞のがん化や老化現象、細胞死を引き起こします。
細菌を用いる復帰突然変異試験(通称Ames試験あるいは変異原性試験)は、がん原性試験との相関性が比較的高く、In vitro試験の代表的な試験として安価で、短期間で結果が得られます。
Ames試験では突然変異を引き起こす物質(変異原物質)が細胞内の遺伝子に作用すると、アミノ酸要求性の細菌株がアミノ酸非要求性の細菌株に変異(復帰)し、アミノ酸の無い条件下でも目視可能なコロニーを形成するため、この復帰したコロニー数を数えることにより、変異原性を有するかどうかを判定します。
Ames試験は、化学物質の遺伝毒性やがん原性の予測に用いられるだけでなく、突然変異物質や発がん物質の作用機序の解明にも用いられています。このため、世界中で広く一般的に行われている遺伝毒性試験の一つとなっており、国内では労働安全衛生法、化審法、医薬品医療機器等法、農薬取締法などすべての化学物質の申請において必須の試験となっています。

試験日程例
試験方法
プレインキュベーション法とプレート法の2種類があります。いずれも各種ガイドラインで認められております。
プレインキュベーション法
被験物質溶液、試験菌液およびS9(または緩衝液)を混合後、37℃で20分間振盪しながらプレインキュベーションして、寒天平板培地に重層します。重層後、インキュベーター内で48時間以上培養し、コロニー数を計数して判定する方法です。
国内発の試験法であり、プレート法よりも変異原性の検出感度が高いとされ、日本国内で一般的に実施されています。
プレート法
プレインキュベーション法の試験操作において、プレインキュベーションを行わない方法です。プレインキュベーション法では、被験液の調製溶媒が試験菌株に対して毒性が出るような場合や、被験物質が不安定でプレインキュベーション法ができない場合などで実施します。
用量設定試験と本試験
用量設定試験
本試験の用量を設定するために行います。最高用量の上限である5000 μg/plateから段階的に用量を設定して実施します。被験物質によっては生育阻害を示す物質もあり、生育阻害を示さない用量として4用量以上が確保できるよう本試験の用量を設定いたします。
本試験
用量設定試験の結果より設定した用量で本試験を実施します。用量設定試験で生育阻害を示さない用量が4用量以上確認できなかった場合は、同一用量の本試験を2回実施して再現性を確認する場合もあります。
判定方法および基準
突然変異を引き起こす物質(変異原物質)が細胞内の遺伝子に作用すると、アミノ酸要求性の細菌株がアミノ酸非要求性の細菌株に変異し、目視可能なコロニーを形成するため、この復帰コロニー数を数えることにより、変異原性を有するかどうかを判定します。
被験物質の用量の増加とともに復帰変異コロニー数が陰性対照値の2倍以上に増加し、再現性が認められた場合に陽性と判定します。この判定方法は2倍法と言います。
また、試験の成立条件の一つとして、陰性対照値、陽性対照値が背景データの管理値範囲内であることを確認しております。
- #Ames試験
- #復帰突然変試験
- #変異原性試験
- #reverse mutation
- #安衛法
- #化審法
- #OECD TG471
- #SIAA
- #S9 mix
- #TA100,TA1535,TA98,TA1537
- #WP2 uvrA
- #塩基対置換型
- #フレームシフト型
- #プレインキュベーション法
- #プレート法
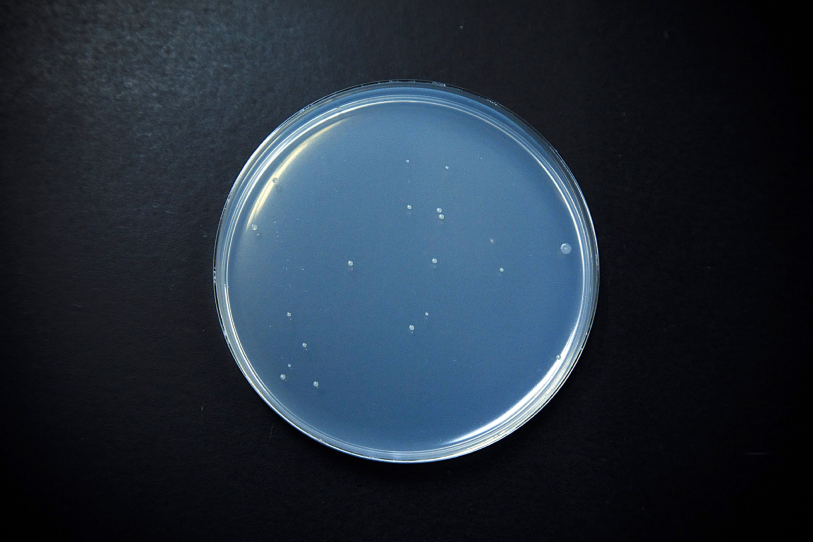
陰性対照

陽性対照
ほ乳類培養細胞を用いる染色体異常試験(以下 染色体異常試験)
染色体異常試験とは
細胞が化学物質等に曝露されることによって,核に障害が引き起こされた場合,その細胞が分裂して作られた娘細胞の染色体に,構造異常 (交換,切断等) または数的異常 (倍数性,異数性) が生じることがあります.これらの異常細胞の出現頻度を,ほ乳類培養細胞を用いて解析するのが染色体異常試験です.主に以下の場合に利用されております.
・医薬品開発: ガイドラインの標準的組合せ
・医療機器,化粧品,化学物質等の登録・申請
・Ames試験の結果の補足,追加データとして
なお,発がん性物質の多くは染色体異常の中で,構造異常を引き起こすものが多いといわれています.

使用細胞
CHL/IU (チャイニーズハムスター由来の肺線維芽細胞)
試験方法
①規定数の細胞をシャーレに播種し培養する.
②細胞に被験物質を暴露させる (代謝活性化系非存在下(-S9 mix) および代謝活性化系存在下 (+S9mix)).
③規定時間細胞に被験物質を暴露させた後,細胞を回収しスライド標本を作製する.
④顕微鏡下で細胞 (染色体の中期分裂像) を観察し,異常細胞 を計数する.
⑤統計処理を行い,陰性対照と比較して有意に異常細胞が増加していれば陽性と判定する.
試験日程例
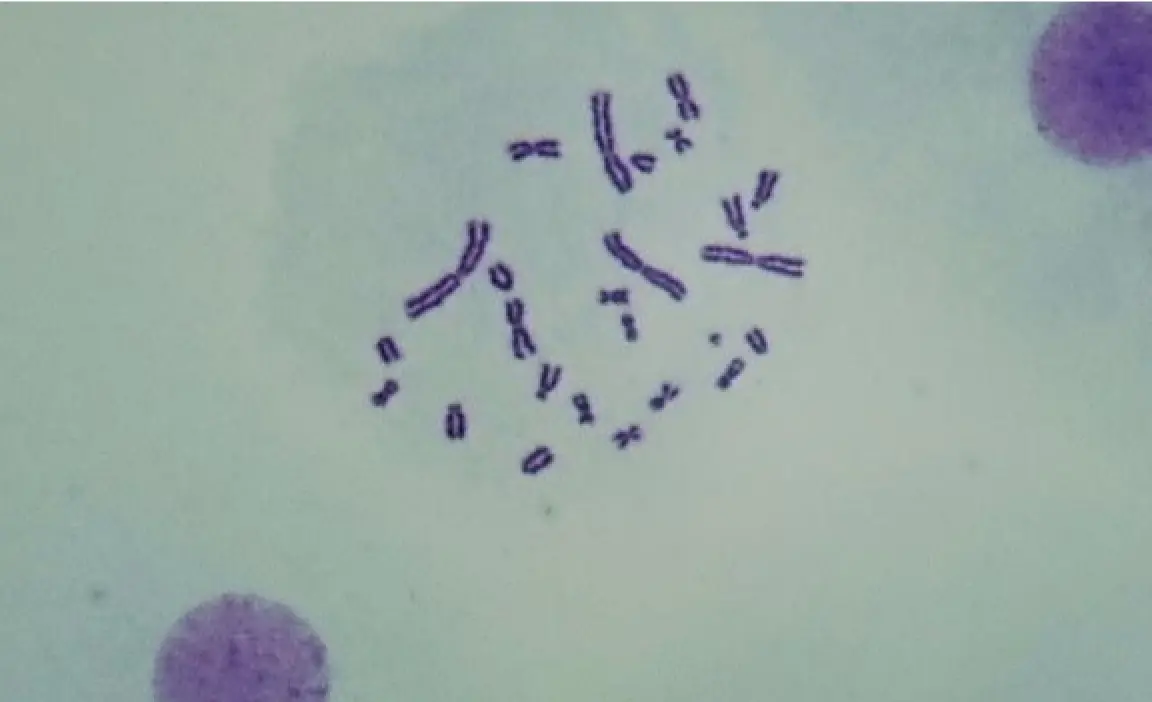
正常細胞
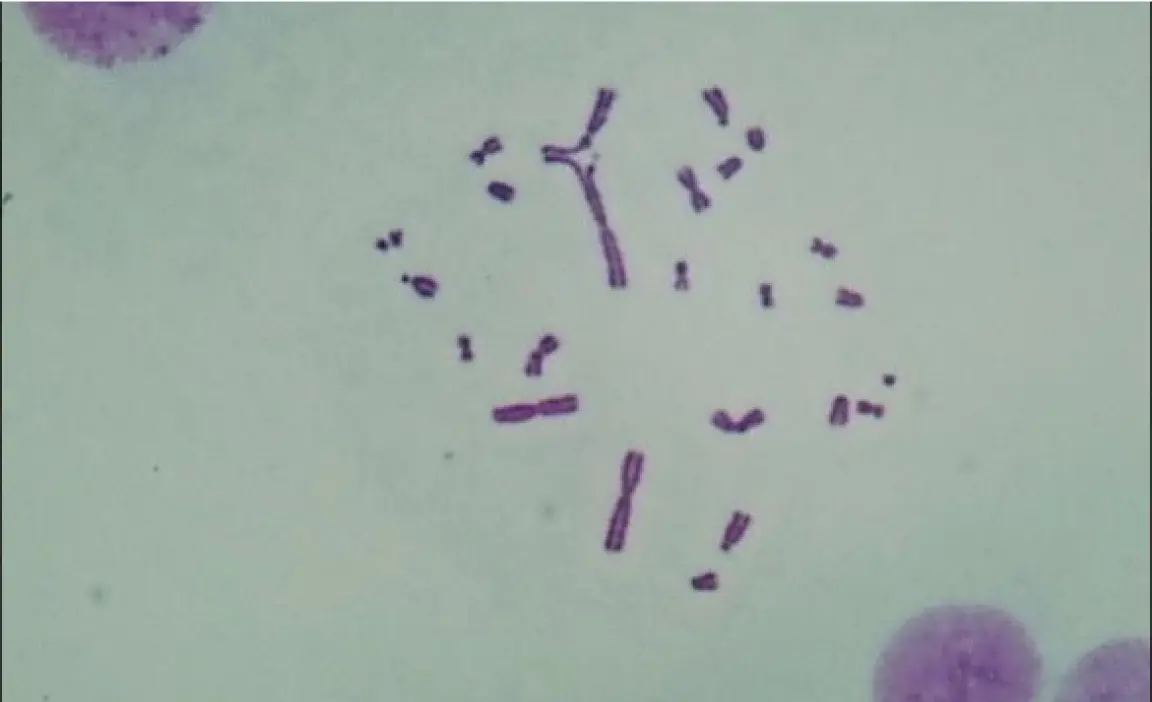
染色体構造異常(交換型)を有する細胞
- #染色体異常試験
- #chromosomal
- #aberration
- #OECDTG473
- #S9 mix
- #CHL/IU
- #チャイニーズハムスター肺線維芽細胞
- #交換型異常
- #切断型異常
- #数的異常
ほ乳類培養細胞を用いる小核試験 (以下 In vitro小核試験)
In vitro小核試験とは
In vitro 小核試験は,大まかに言ってしまえば前述の染色体異常試験と同義の試験となります.細胞中で誘発される染色体異常を,染色体異常試験では染色体像を観察していますが,in vitro 小核試験では細胞質内の主核とは異なる小さな核 (小核) の有無を観察いたします.
染色体異常試験に比べ,標本観察が簡便であることが利点です.
・医薬品開発: ガイドラインの標準的組合せ
・医療機器,化粧品,化学物質等の登録・申請

使用細胞
CHL/IU 細胞 (チャイニーズハムスター由来の肺繊維芽細胞)
TK6 細胞 (ヒト由来のリンパ芽球細胞)
試験方法
①規定数の細胞をシャーレに播種し培養する.
②細胞に被験物質を暴露させる (代謝活性化系非存在下(-S9 mix) および代謝活性化系存在下 (+S9mix)).
③規定時間細胞に被験物質を暴露させた後,細胞を回収しスライド標本を作製する.
④顕微鏡下で細胞を観察し,小核を有する細胞を計数する.
⑤統計処理を行い,陰性対照と比較して有意に小核を有する細胞が増加していれば陽性と判定する.
試験日程例【in vitro 小核(CHL)】
試験日程例【in vitro 小核(TK6)】

正常細胞

小核を有する細胞
- #小核試験
- #micronucleus
- #OECD TG487
- #S9 mix
- #CHL/IU
- #チャイニーズハムスター肺線維芽細胞
- #TK6
げっ歯類を用いる小核試験 (以下 in vivo 小核試験)
In vivo小核試験とは
In vivo 小核試験とは 動物個体内で誘発される染色体異常を検出する試験です.遺伝毒性試験の分野で最も多く実施されているin vivo 試験であり,主に以下の場合に利用されております.
・医薬品開発: ガイドラインの標準的組合せ
・医療機器,化粧品,化学物質等の登録・申請: in vitro の遺伝毒性試験で陽性になった場合
・その他in vivo において遺伝毒性評価が必要な場合
In vivo 小核は赤血球内にできる小核 (小さな核) を指標として,染色体異常誘発性の有無を調べます.赤血球は骨髄中で生成されるため,被験物質の骨髄における曝露証明が必要になる場合があります.
使用動物
マウス (ICR系)
ラット (SD系)
試験方法
①動物に被験物質を投与 (経口,腹腔,静脈内等) する.
②大腿骨から骨髄細胞を回収し,塗抹標本を作製する.
③顕微鏡下で赤血球を観察し,小核が誘発されている細胞 (MNIME) を計数する.
④統計処理を行い,陰性対照と比較して有意にMNIMEが増加していれば陽性と判定する.
なおDSTCでは,固定した骨髄細胞をリトロン社製のキットで標識し,フローサイトメーターで解析する手法も実施しています.
試験日程例
In vivo 小核試験の正常細胞
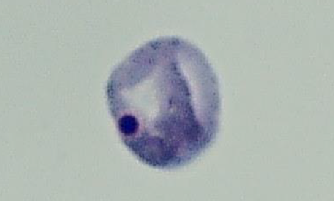
In vivo小核試験の小核を有する細胞
- #小核試験
- #micronucleus
- #OECD TG474
- #幼若赤血球
- #多染性赤血球
- #脱核